和美药业冲击IPO,泰格医药参投,尚无产品上市
近期,创新药行情来势汹汹,三生制药、石药集团、翰森制药、信达生物、复宏汉霖、康方生物等个股表现亮眼,次新股映恩生物-B自上市首日翻倍之后,今天又大幅上涨13%。
与此同时,又有创新药公司冲击港股IPO。
格隆汇获悉,赣州和美药业股份有限公司(简称:和美药业)近期递表港交所,根据上市规则第18A章寻求在联交所主板上市,国证国际为其独家保荐人。
和美药业2002年成立,是一家创新驱动的生物制药公司,致力于发现和开发针对自身免疫性疾病和肿瘤的小分子药物,主要治疗领域包括银屑病(Ps)、白塞病(BD)和炎症性肠病(IBD)等。
截至2025年5月21日,张和胜博士和郭雪梅夫妇二人合计控制公司约46.51%的投票权,连同赣州和胜、香港和美及其控股公司以及赣州和毅构成一组控股股东。
公司在发展的过程中,获得过多轮投资,总募集资金约为9.51亿元,主要机构投资者包括上海千骥、泰格投资、泰鲲投资及倚锋睿意等;其中在2024年9月的E轮融资中,公司的投后估值为39亿元。
目前,和美药业已开发7个小分子候选药物,针对具有高度未满足需求的自身免疫和肿瘤疾病。其中4种候选药物处于II期、III期临床试验或NDA阶段,适用于12种适应症。
招股书称,研究产品管线中的两款创新药物(Mufemilast和Hemay181)有望成为中国同类首创药物。
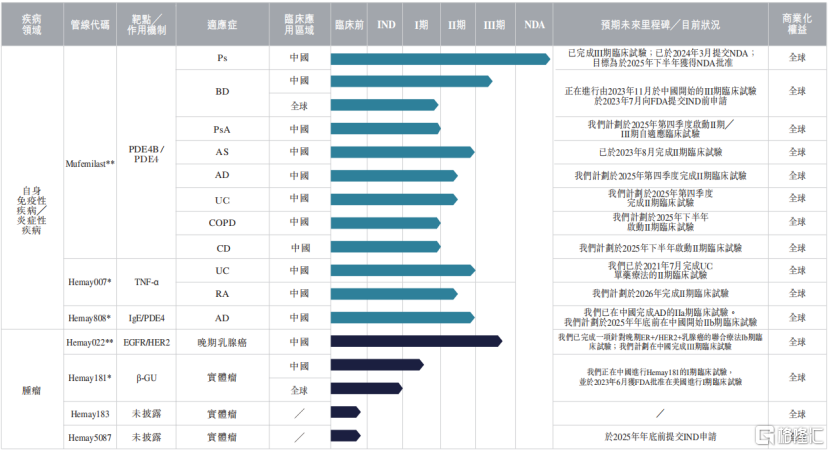
公司产品管线,来源:招股书
1、核心产品及创新管线
Mufemilast:
核心产品Mufemilast是一种新型小分子磷酸二酯酶4B(PDE4B)蛋白表达阻断剂和PDE4抑制剂,具有广泛的自身免疫性疾病治疗潜力。根据弗若斯特沙利文,Mufemilast可能是一种具有双重作用机制的全球同类首创药物:其既可阻断PDE4B蛋白的表达,也可抑制PDE4的活性。
Mufemilast不会引起血管炎,也不会轻易穿过血脑屏障,从而减少了中枢神经系统副作用,如抑郁和自杀倾向。截至2025年5月21日,Mufemilast也是唯一可直接用于有潜伏性结核感染的Ps患者的药物,其安全性获III期临床试验支持。
目前,和美药业正在中国和全球实行针对Mufemilast的八项主要适应症的临床开发计划,包括Ps(银屑病)、BD(白塞病)、PsA(银屑病关节炎)、AS(强直性脊柱炎)、AD(特应性皮炎)、UC(溃疡性结肠炎)、COPD(慢性阻塞性肺病)和CD(克罗恩病)。
其中针对Ps适应症的进展最快,2024年3月公司向国家药监局提交针对Ps的NDA(新药生产上市注册申请),该申请已于2024年5月获授优先审评审批资格,目标为2025年下半年获得NDA批准上市。
在风湿免疫科数量增加、庞大的患者群体和长期治疗需求、公众意识的提高等因素的拉动下,我国自身免疫疾病治疗药物的市场不断增长。
根据国家卫健委的统计数据,中国约有8000万人患有自身免疫疾病。中国自身免疫疾病药物市场从2019年的25亿美元增长到2023年的40亿美元,自2019年至2023年的复合年增长率为12.5%。估计到2032年将达到26.3十亿美元,自2023年至2032年的复合年增长率为23.3%。
其中,2023年,中国Ps药物市场规模达到139亿元,自2019年至2023年的复合年增长率为30.4%。预计到2032年,市场规模将增至894亿元,自2023年至2032年的复合年增长率为59.1%。
中国已批准或正在开发多种小分子疗法用于治疗Ps。已批准的治疗药物包括艾伯维的Rinvoq(乌帕替尼,一种JAK1抑制剂)和百时美施贵宝的Sotyktu(德卡伐替尼,一种TYK2抑制剂)。此外,还有多种候选药物正处于临床开发阶段。
Hemay022:
核心产品Hemay022是一种新型EGFR/HER2双靶点小分子抑制剂,旨在治疗晚期乳腺癌。Hemay022通过与EGFR和HER2形成不可逆共价键发挥药效,从而抑制PI3K/Akt和MAPK信号通路的传导。
截至目前,和美药业正在进行一项针对晚期ER+/HER2+乳腺癌的III期联合疗法临床试验。主要目标是基于患者的无进展生存期(PFS),评估Hemay022与芳香化酶抑制剂(依西美坦或来曲唑)联合治疗晚期ER+/HER2+乳腺癌患者的疗效。公司计划于2026年在中国向国家药监局提交的NDA。
2023年,中国的乳腺癌发病率为36.51万例,自2019年至2023年的复合年增长率为2.5%,预计到2032年将增加到43.58万例。中国已批准或正在开发多种针对EGFR和HER2通路的小分子疗法用于乳腺癌治疗。
2、临床阶段候选药物
Hemay007:是一种TNF-α小分子调节剂,已完成单药治疗UC的II期临床试验,正在进行类风湿关节炎的II期临床试验。
Hemay808:是一种靶向IgE和PDE4的新型分子实体,已于中国完成治疗特应性皮炎的IIa期临床试验,且计划在2025年年底前于中国启动IIb期临床试验。
Hemay181:是一种具有专有作用机制的潜在同类首创拓扑异构酶I靶向SDC药物,正在中国开展Hemay181的I期临床试验。
此外,公司正在进行Hemay183和Hemay5087的临床前研究。
当然,创新药的开发具有较高的风险。招股书称,公司不能保证NDA批准的时间以及任何进一步要求、后续III期临床试验的结果,或者NDA批准是否会最终获得。国家药监局可能要求提供更多资料,包括额外的临床前或临床数据,这可能会延迟或阻碍批准与商业化计划,或者可能导致放弃开发计划。
此外,未来如果任何候选药物产生不良副作用或安全问题,国家药监局可能要求建立风险评估和缓解措施,例如限制药物的分销并对公司实施繁重的实施要求。
财务方面,由于和美药业目前并没有获批准商业销售的产品,因此没有自产品销售产生任何收益。2023年和2024年(报告期),除税前亏损分别为1.56亿元和1.23亿元。和美药业目前绝大部分的亏损来自研发开支、一般和行政开支。
截至2024年12月31日,和美药业一共拥有122名研发和临床团队成员。报告期内,公司的研发开支分别为1.23亿元、9700万元。
2024年研发开支有所减少,主要是因为:1、 Mufemilast Ps III期试验的临床试验费用因该产品进入NDA阶段而有所减少;2、Hemay022 III期临床试验期间,治疗及安慰剂组的患者入组数量减少,导致临床研究及服务费下降。
在销售方面,公司计划采用直接销售及与第三方合同销售组织(CSO)合作的双重战略。目标是在Mufemilast推出市场的一年内建立约80人的商业化团队。
报告期内,公司的经营活动所用现金净额分别为1.41亿元及9130万元。截至2024年年底,公司账上现金及年末现金和现金等价物为1.5亿元。
据招股书,和美药业董事认为,考虑到公司的现金消耗率,营运资金可以未来12个月内至少125%的成本,包括研发开支、一般和行政开支以及销售和营销开支。
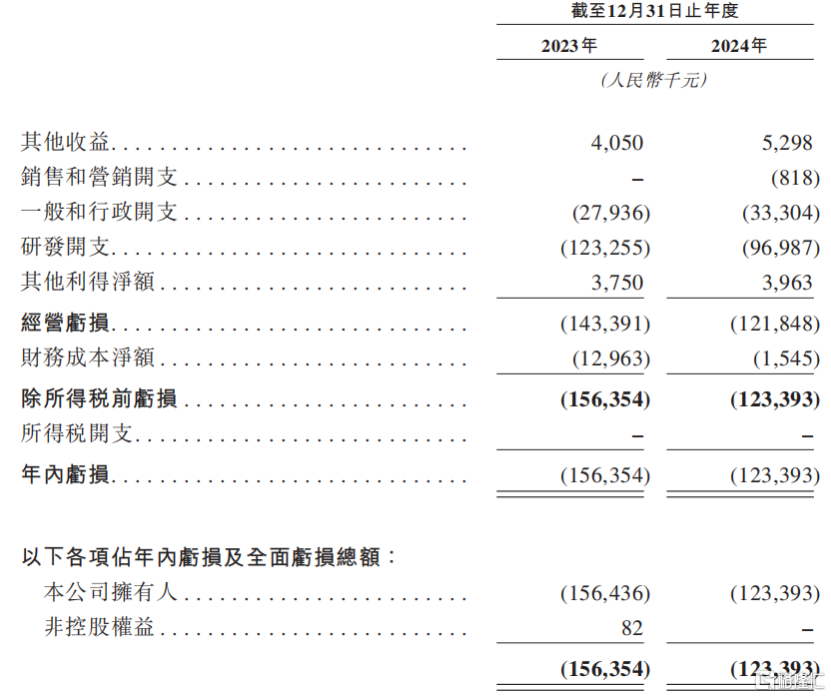
关键财务数据,来源:招股书
截至2024年年底,和美药业的流动资产净值为450万元,2025年3月31日(未经审计)则出现流动负债2550万元,财务状况存在波动。由于研发投入巨大且尚未产生收入,公司将继续面临经营亏损和现金流压力。
总体而言,和美药业专注于自身免疫疾病和肿瘤领域,目前尚未有产品上市,核心产品最快预计于2025年下半年获批。未来,公司产品关键数据能否打动药监局并获批准,格隆汇将保持关注。
交易商排行
更多- 监管中EXNESS10-15年 | 英国监管 | 塞浦路斯监管 | 南非监管92.42
- 监管中FXTM 富拓10-15年 |塞浦路斯监管 | 英国监管 | 毛里求斯监管88.26
- 监管中axi15-20年 | 澳大利亚监管 | 英国监管 | 新西兰监管81.40
- 监管中GoldenGroup高地集团澳大利亚| 5-10年85.87
- 监管中Moneta Markets亿汇澳大利亚| 2-5年| 零售外汇牌照79.67
- 监管中GTCFX10-15年 | 阿联酋监管 | 毛里求斯监管 | 瓦努阿图监管60.85
- 监管中VSTAR塞浦路斯监管| 直通牌照(STP)80.00
- 监管中IC Markets10-15年 | 澳大利亚监管 | 塞浦路斯监管91.81
- 监管中markets4you毛里求斯监管| 零售外汇牌照| 主标MT4| 全球展业|75.06
- 监管中CPT Markets Limited5-10年 | 英国监管 | 伯利兹监管91.56


